聚磷菌透射电镜超薄切片样品制备过程的优化(环保)
聚磷菌透射电镜超薄切片样品制备过程的优化(环保)
孟丹杰, 庄林杰, 王琦, 田晴*, 李方, 杨波
(东华大学环境科学与工程学院,上海201620)
摘要:透射电镜样品的制备条件与步骤会对聚磷菌(phosphorus accumulating orgmusms,PAOs)细胞内超微结构的观察产生影响。以纯培养、混合培养条件下生长的聚磷菌为观测对象,在常规的透射电镜制样方法的基础上,采用新的清洗、固定、染色策略,进而提出一种适合不同生长条件下聚磷菌的透射电镜制样新方法。实验结果表明,新方法比常规方法更简便有效;并且采用新方法制备样品,不同培养条件下生长的PAOs体内聚磷(poly-Ps)颗粒在采用透射电镜观察时超微结构清晰、反差效果较好。
关键词:透射电镜;制样;聚磷菌 中图分类号:X172;TN16 doi:10.3969/j.issn.1003-6504.2016.06.020 文章编号:1003-6504(2016)06-0105-05
随着工业迅速发展,水体富营养化问题日益严重,而导致该问题的主要原因是磷过量,因此除磷技术成为控制水体富营养化的关键。除磷方法有很多种,其中最常用和经济有效的是生物法。生物除磷过程中起关键作用的是聚磷菌(phosphorus accumulatingorganisms,PAOs),PAOs的除磷功能与其胞内聚合物如多聚磷酸盐( poly-Ps)、聚羟基烷酸酯(PHAs)、糖原(glycogen)等有关。
鉴于PAOs胞内聚合物的重要性,常对其进行定性和定量分析测定,一般通过染色并借助光学显微镜观察PAOs体内poly-Ps颗粒的分布情况。然而,光学显微镜的分辨率仅为0.2μm,无法清晰观测PAOs体内直径在0.2μm以下的多聚物颗粒,而电子显微镜的分辨率可达1~2 nm。因此,需要采用具有高分辨率、高放大倍数的电子显微镜来对PAOs体内poly-Ps颗粒进行精确地定性及定量观测。
电子显微镜是研究生物超微结构的重要工具,
主要有扫描电镜(scanning electron microscope,SEM)
和透射电镜(transmission electron microscopy,TEM)
两大类。TEM是把经加速和聚集的电子束投射到非 常薄的样品上,电子与样品中的原子碰撞而改变方向,从而产生立体角散射,散射角的大小与样品的密度、厚度相关,因此可以形成明暗不同的影像。TEM样品的制备是准确观察、测定PAOs胞内多聚物的重要保障。随着透射电镜样品制备方法的不断改进,超薄切片技术已成为最基本、最常用的透射电镜生物样品制备技术。
常规的超薄切片技术的制样过程比较复杂,一般为:取材、固定、清洗、脱水、浸透、包埋、超薄切片及染色等步骤。以常规方法中的固定步骤为例,通常采用戊二醛和四氧化锇进行双固定。然而,四氧化锇(又名锇酸),是一种非电解质强氧化剂,容易与核酸及多聚磷酸盐等细胞内含磷单元反应,但也同样会与细菌细胞内大量存在的C、O、N等嗜锇元素反应形成黑色沉淀,对聚磷酸盐的观察产生干扰。此外,锇酸渗透性差,对大分子聚合物的固定性差,因此不适合用于对体内多聚物种类丰富、含量高的聚磷菌的固定。并且不同生长条件下的聚磷菌具有不同的生长方式,例如混合培养条件下生长的聚磷菌会以菌胶团或者生物膜的方式聚集生长,细胞外存在大量由蛋白质、多糖等构成的胞外聚合物,对准确观测聚磷菌菌体的超微结构带来影响。
因此在已有制样方法的基础上,针对纯培养条件下以及混合培养条件下生长的聚磷菌,探索出新的透射电镜超薄切片制样方法,以便为清楚地观察聚磷菌体内聚磷颗粒分布、研究聚磷菌生长过程中最优摄磷条件奠定基础。
1试验材料和方法
1.1试验材料
聚磷菌:所用到的聚磷菌有2种。(1)经分离、筛选与纯化得到的纯聚磷菌,并鉴定其为恶臭假单胞菌(Pseudomonas putida;(2)从实验室运行稳定的厌氧——好氧交替式生物滤池( AABF)中取得的生物膜,即聚磷菌和具有除磷功能的其他细菌组合而成的混菌落。
固定剂:戊二醛(2.5%)溶液。
清洗剂:二甲砷酸钠(SCB)缓冲溶液(0.1 mol/L)。
染色剂:浓度为2%和10%的P b( NO2)。溶液。
脱水剂:30%、50%、70%、90%的梯度乙醇,1:1液(100%无水丙酮:100%无水乙醇),100%无水丙酮。
包埋剂:环氧树脂618。
1.2试验方法
实验流程见图1,即先采用常规TEMSP对纯培养条件下的聚磷菌制样,由于聚磷菌的特殊性,电镜下未能分辨出菌体内poly-Ps颗粒。而改进清洗剂、固定剂、染色时序和切片厚度,电镜观察效果较好,便采用该改进方法对混合培养条件下的聚磷菌(生物膜)进行制样,电镜观察效果并不理想,经对2种培养条件下聚磷菌的不同对比分析后,提高染色剂浓度、加长清洗时间再次对生物膜制样,电镜观察效果良好。从而得到适合2种培养条件下聚磷菌的TEMSP。
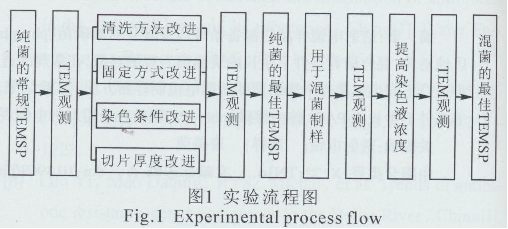
1.2.1取材
同常规制样方法一样,对2种生长条件下的聚磷菌取材时需遵循5个原则。(1) “快”:为使聚磷菌保持其生活状态,需要在1—2 min内使所取样品浸入固定剂;(2)“小”:电镜固定剂穿透能力较弱,为了利于固定剂渗透到样品中,需使样品体积小于1 mm3; (3)“冷”:为防止聚磷菌细胞自溶,需要低温操作来降低酶的活性,一般需在0~4℃低温条件下操作;(4)“准”:为避免“一孔之见”,取材部位要准确;(5)“轻”:取材动作要轻,避免任何牵拉和挤压损伤。
1.2.2清洗
为防止清洗过程中PBS缓冲溶液中磷的干扰,可采用0.1 mol/L的SCB缓冲溶液来代替PBS缓冲溶液。也可用生理盐水(0.85%的Na Cl溶液)代替0.1 mo/L的SCB缓冲溶液,以便维持溶液的pH以及渗透压。
具体清洗步骤为:将所取聚磷菌样品置于1.5 m L离心管中,滴加适量0.1 mo/L的SCB缓冲溶液至浸没聚磷菌样品,以4000~5000 r/min转速离心后弃上清液,重复上述操作10次(操作过程中离心转速可以逐渐增大,至最后一次离心转速为10000 r/min左右)。
1.2.3固定
常用的固定剂有:四氧化锇、醛类(戊二醛、甲醛等)。常规的透射电镜生物样品制备时采用戊二醛和四氧化锇双固定的方法:将样品置于2.5%戊二醛(由0.2 mol/L的磷酸(PBS)缓冲溶液配制)固定液中,4℃固定2h或更长时间;固定后用0.1 mol/L的PBS缓冲液(pH=7.2~7.3)漂洗3次;漂洗后再用i%锇酸固定液4℃固定1~2 h;最后用0.1 mol/L的PBS缓冲溶液漂洗3次,以上每次漂洗时间均为15~20 min。然而,四氧化锇(又名锇酸),是一种非电解质强氧化剂,容易与核酸及多聚磷酸盐等细胞内含磷单元反应,会与细菌细胞内大量存在的C、O、N等嗜锇元素反应形成黑色沉淀,进而对聚磷酸盐的观察产生干扰。此外,锇酸渗透性差,对大分子聚合物的固定性差,因此不适合用于体内多聚物种类丰富、含量高的聚磷菌的固定。戊二醛可以保持酶的活性,用它作为固定剂时,不会使细胞或组织变脆,固定时间最长可达1个月。并且戊二醛具有分子量小、渗透性好,能同时固定细胞内的基质、糖原、核酸、聚磷等成分。因此制备聚磷菌的透射电镜样品时,只需用戊二醛作为固定液。2.5%的戊二醛固定液(pH=7.4)的配制:0.2 mol/L的二甲砷酸钠(SCB)缓冲溶液25mL,25%的戊二醛5 m L,滴加重蒸水( d d H2O)至50mL。
将所取聚磷菌样品用0.1mo/L的SCB缓冲溶液充分清洗后,置于2.5%的戊二醛固定液(pH=7.4)中,于4℃且不见光的环境下固定至少2 h。固定结束后采用1.2.2节所述方法对样品清洗3次。注意加入固定液时,需沿离心管壁缓慢加入,以保证聚磷菌细胞团聚;并且固定液需加至管盖处,以防絮体在移动样品过程中破碎。
1.2.4染色
1.2.4.1染色剂的种类及其染色时序的改进
常规的透射电镜制样过程中的染色仅在超薄切片制好后,用3%醋酸铀与枸橼酸铅进行双染色。然而,对聚磷菌的透射电镜样品制备时若采用该染色方法会造成细胞内所有组成均被染成灰色或黑色,很难分辨聚磷菌体内的poly-Ps颗粒。因此,需要在细胞仍具有一定活性时(脱水前),采用能够与磷形成沉淀的Pb( NO3)2溶液进行染色。
由于采用Pb (NO3)2溶液染色后,已经可以清晰分辨电镜所拍摄的poly-Ps颗粒,无需在样品包埋切片后继续染色。因此将细菌包埋切片后染色改为细菌脱水前染色。
1.2.4.2不同生存状态下的聚磷菌的染色要求
对于纯培养条件下生长的聚磷菌和混合培养条件下生长的聚磷茵,需要采用不同浓度的Pb( NO3)2溶液(2%~10%)进行染色。在纯培养条件下,培养基内营养充分,聚磷菌在液体培养基内形成浊度比较高的细菌溶液,菌体聚集度小,保持分散生长状态,胞内的多聚物数量较少,因此,对纯培养条件下生长的聚磷菌染色时,可以采用低浓度的Pb( NO3)2溶液(2%)进行染色1h。但如果聚磷菌样品来自混合培养的生长条件,聚磷菌胞外存在大量多聚物(由蛋白质与多糖构成),会限制染色过程中Pb( NO3)2溶液的扩散,为减少染色时间,可根据菌胶团与生物膜老化程度改变Pb( NO3)2溶液浓度,如对生物膜内聚磷菌染色可采用高浓度的P b( NO3)2溶液(10%)染色1h,才能够保证P b( NO3)2溶液能充分渗透进入生物膜内聚磷菌体内,对poly-Ps颗粒染色成功。注意Pb( NO3)2溶液需要现配现用;并且染色后的清洗次数要随染色液浓度的提高而适当增加。染色结束后仍采用1.2.2节所述方法对样品清洗3次。
1.2.5脱水
同常规方法,采用梯度乙醇-丙酮系列脱水法:先用浓度分别为30%、50%、70%、90%的乙醇各脱水1次,再用1:1液(100%无水丙酮:100%无水乙醇)脱水1次,最后用100%无水丙酮脱水3次,以上每次脱水时间均为15~20min。
1.2.6渗透和包埋
先将样品浸透,即取适量100%无水丙酮和包埋剂(1.1节所述)的混合液(V/V=1:1),移至装有经以上处理的样品的离心管中,使混合液淹没样品,打开离心管盖并静置过夜。然后将渗透后的样品包埋,即加纯包埋剂渗透2h(样品需在1min之内浸到包埋剂底部,若样品悬浮在树脂中,则要加少许丙酮至样品沉到底部并过夜,第2天换纯包埋剂浸透12~24 h)。
最后将样品聚合:即先把包埋剂注入包埋板孔中,再将样品从离心管中取出迅速摆放在包埋板孔中,聚合温度和时间:35℃,16h;45℃.24h;60℃,48h。自然降温,待切片。
1.2.7切片
包埋块在超薄切片机中切片。由于切片质量直接关系到电镜观察的结果,因此超薄切片是样品制备的关键环节。电子穿透能力较弱,样品必须制成厚度小于0.1![]() m的超薄切片,常用的超薄切片厚度是50~60 nm,这一厚度的超薄切片在电子束轰击过程中容易产生振动(难于维持稳定),会影响电镜观察与拍摄过程效果。
m的超薄切片,常用的超薄切片厚度是50~60 nm,这一厚度的超薄切片在电子束轰击过程中容易产生振动(难于维持稳定),会影响电镜观察与拍摄过程效果。
为了提高透射电镜图片的清晰度,可以将超薄切片的厚度增加到90nm。
2结果与讨论
采用常规TEM超薄切片制样方法对纯培养条件下的聚磷菌进行制样,即用戊二醛和锇酸双固定、PBS缓冲溶液清洗、切片后再用3%醋酸铀与枸橼酸铅进行双染色,在透射电镜下观察,结果如图2(a)所示,聚磷菌细胞内所有组分均被染成灰色或黑色,无法分辨出菌体内的poly-Ps颗粒,并且缓冲溶液中的磷会残留在细胞表面与固定剂反应,干扰poly-Ps颗粒的观测。
改变清洗剂和染色条件再次对纯培养条件下的聚磷菌进行制样,即将染色剂改为2%的Pb( NO3)2溶液并将染色步骤改至脱水前,且用0.1 mol/L的SCB溶液代替PBS缓冲溶液,但仍采用2.5%的戊二醛和1%的锇酸进行双固定,在透射电镜下观察,结果如图2(b)所示,由于锇酸会与菌体内的poly-Ps颗粒反应,无法正确反映poly-Ps颗粒的数量及分布情况,且细胞内大量存在的C、N、O等噬锇元素与锇酸反应生成黑色沉淀,同样干扰菌体内poly-Ps颗粒的观测。
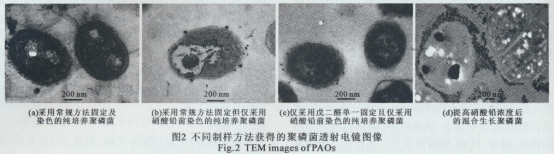
改变固定方式再次对纯培养条件下的聚磷菌进行制样,即对比图2(b)所述制样方法,除固定时仅采用2.5%戊二醛进行固定外,其他制样过程不变,在透射电镜下观察本制样条件下获得的样品,结果如图2(c)所示,不仅能清晰观测到聚磷菌体内poly-Ps颗粒的数量和分布情况,还能观测其形状,并且细胞结构完整。比较图2(a)、(b)、(c)表明:仅使用2.5%的戊二醛作为固定剂,用0.1 mol/L的SCB代替PBS缓冲溶液,且采用2%的Pb( NO3)2溶液进行脱水前染色,即可达到纯培养条件下生长的聚磷菌体内poly-Ps颗粒的观测目标。
然而,对于混合培养条件下生长的聚磷菌,由于其大部分细胞在胞外聚合物作用下聚集生长,实验初期,仅采用上述针对纯培养聚磷菌的制样方法获得的样品,在透射电镜下观察后,发现染色后的聚磷菌体内并无任何黑色颗粒物,说明染色不充分,需要提高染色剂浓度并延长染色时间。
为节约制样时间,本研究提高Pb( NO3)2染色剂浓度,即将硝酸铅溶液的浓度由2%提高到10%,其它制样条件不变,再次对混合培养条件下生长的聚磷菌进行制样,在电镜下观察,结果如图2(d)所示。可以发现,虽然染色剂浓度提高5倍,并未对菌体内组分观察产生影响(菌体内组分颜色并未因此加深),菌体内、外的黑色颗粒物清晰可见,说明Pb选择性地与细胞内外的磷反应生成黑色的沉淀物,该结果与文献所报道的采用化学分析法获得的磷在聚磷菌体、内外分布结果一致:即,废水中的磷可以被聚磷菌能够吸收,部分磷被聚磷菌利用在体内合成poly-Ps、部分磷会被聚磷菌胞外的多聚物(主要由蛋白质与多糖构成)通过吸附、网捕作用固定在细胞表面。
上述结果表明,纯培养聚磷菌多为分散生长,在观测中,没有在菌体周围发现明显的胞外聚合物,因此,采用低浓度的Pb( NO3)2溶液,便可保证Pb2+能在既定的染色时间(1 h)内渗入聚磷菌细胞内,保证对聚磷菌体内的磷颗粒染色。而对于混合培养的聚磷菌,在观测中,可以发现聚磷菌细胞外存有大量的多聚物,这些多聚物不仅因为含有磷而消耗染色剂中的Pb2+,而且因其大量存在所形成的空间位阻,会降低Pb2+向细胞内的渗透性。因此,为保证对混合培养条件下聚磷菌体内磷充分染色,需要提高染色液内Pb2+浓度。因此仅使用2.5%的戊二醛作为固定剂,用0.1 mol/L的SCB代替PBS缓冲溶液,且采用10%的Pb( NO3)2溶液进行脱水前染色,就可以达到混合培养条件下生长的聚磷菌体内poly-Ps颗粒的观测目标。
3结论
总结上述过程,聚磷菌的透射电镜制样过程为:取材、清洗、固定、清洗、染色、清洗、脱水、浸透与包埋、切片、电镜观察。其中纯培养和混合培养条件下的聚磷菌除染色时所用的Pb(NO3)2溶液浓度不同及染色后清洗时间长短不同外,制样的其他步骤相同。
由透射电镜观察结果知,采用常规透射电镜生物制样方法对聚磷菌制样时,无法清晰辨别聚磷菌的细胞质与其胞内聚合物;采用改进后的制样方法制备聚磷菌样品时,操作简便,并且固定彻底、渗透均匀,染色清晰,聚磷菌细胞内结构完整,易于区分细胞质与胞内聚合物,图像反差效果好。

